Invitados (4)
Artículos científicos comentados por destacados profesionales invitados por la Cátedra a tales efectos. Si usted también desea publicar en nuestra web, puede contactarse con la secretaría de la Cátedra o a través del Contacto.
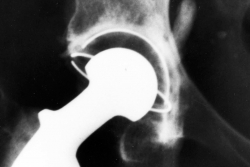
Artículo de Revisión: Infección de prótesis articulares
ARTÍCULO DE REVISIÓN
Infección de prótesis articulares
Dra. Karina Tenaglia
La mayor expectativa de vida de la población mundial ha incrementado el uso de procedimientos invasivos en medicina. Dentro de éstos, el implante de prótesis articulares y dispositivos osteoarticulares es un tema de interés. La complicación infecciosa afecta la calidad de vida de los pacientes y determina un aumento de los costos sanitarios 1 generando una elevada morbilidad en la población añosa, pudiendo exponerlos hasta a tres procedimientos quirúrgicos, cuadruplicando el gasto inicial del implante. Datos internacionales muestran esta complicación en 0,3 a 1,7% de la prótesis total de cadera (PTC) y 0,8 a 1,9% en prótesis total de rodilla (PTR) 2. En los implantes osteo–articulares es variable, de 3 a 25%3.
Datos nacionales del Ministerio de Salud Pública (2010) muestran: infección del sitio quirúrgico global, 3,3% de 2884 prótesis de rodillas, 3,5% de 5583 prótesis totales de cadera y en el 4,9% de 2122 de prótesis parciales de cadera4.
Vancomycin pharmacokinetic–pharmacodynamic parameters to optimize dosage administration in critically ill children
Giachetto G, Telechea H, Speranza N, Oyarzum M, Nanni L, Menchaca A. Vancomycin pharmacokinetic–pharmacodynamic parameters to optimize dosage administration in critically ill children. Pediatr Crit Care Med. 2011;12(6):250-4
Comentan: Dres. Fiorella Tomas, Héctor Telechea.
Se analizará el artículo original “Vancomycin pharmacokinetic–pharmacodynamic parameters to optimize dosage administration in critically ill children” publicado en Pediatric Crital Care Medicine en 2011.
Vancomicina es un antibiótico glucopéptido de amplio uso en la práctica clínica. El consumo de este antibiótico ha aumentado en los últimos años en nuestro medio, en especial desde la aparición de Staphylococcus aureus meticilino resistente a nivel comunitario.
La misma presenta propiedades farmacocinéticas complejas. La dosis habitual es 1 g por vía intravenosa cada 12 horas, presenta una vida media de eliminación de 4 a 8 horas en pacientes con función renal normal y aumenta en insuficiencia renal. Su volúmen de distribución es 0,39 a 0,92 lt/k. Las concentraciones plasmáticas consideradas terapéuticas son 25-40 mg/l para la concentración máxima y 5-12 mg/l para la concentración mínima.
En los últimos años se ha comenzado a prestar atención al parámetro farmacocinético y farmacodinámico que mejor describe la erradicación microbiológica producida por vancomicina sobre Staphylococcus. Este parámetro es el área debajo de la curva en 24 horas (ABC24) en relación a la Concentración inhibitoria mínima (CIM) de Staphylococcus.
Se ha establecido principalmente en pacientes adultos, que alcanzar valores de ABC24 /CIM > 400, se asociaría a mejor pronóstico de las infecciones estafilocócicas, especialmente si estos valores fueron obtenidos durante el primer día del tratamiento. No se ha establecido si el régimen de dosificación habitualmente recomendado de vancomicina en niños criticamente enfermos es adecuado para alcanzar dicho valor.
Para determinar si estos regimenes posológicos son adecuados se realizó un estudio de farmacocinética clínica en la Unidad de Cuidados Intensivos de Niños (UCIN) del Centro Hospitalario Pereira Rossell. El objetivo del mismo fue calcular los parámetros farmacocinéticos de vancomicina en niños críticamente enfermos y estimar el valor del ABC24/CIM para S. aureus alcanzado con la dosis actual recomendada de vancomicina.
Se incluyeron en el estudio aquellos niños hospitalizados en UCIN y que recibían tratamiento antibiótico con vancomicina, independientemente de la indicación de la misma. Los pacientes con alteración de la función renal fueron excluidos.
Vancomicina fue administrada por vía intravenosa durante 1 hora cuatro veces día. La dosis fue 40 mg/kg/día para el tratamiento de infecciones extrameningeas y 60 mg/Kg/día para infecciones del SNC. Las muestras para la dosificación plasmática fueron obtenidas el primer día de tratamiento. Para la determinación de la concentración máxima (Cmax) se obtuvo muestra de sangre 1 hora después de la tercera dosis administrada, y para obtener la concentración mínima (Cmin) se tomó una muestra plasmática 15 minutos previo a la siguiente dosis. Valores de Cmax de 20-40 μg/ml y 5-0 μg/ml de Cmin fueron considerados como valores terapéuticos. Se calculó el volúmen de distribución (Vd) y vida media de eliminación (t1/2) mediante la aplicación de un software de farmacocinéticas clínica, asumiendo un modelo monocompartimental. El clearence fue calculado según la fórmula Cl= ln2 x VD / t ½. El ABC24 se calculó mediante la fórmula Dosis diaria /Cl.
Participaron del estudio 22 niños, 12 de sexo masculino, con una media de edad de 38 meses. En el primer día de tratamiento 7/18 niños alcanzaron un valor de Cmax dentro del rango terapeútico, y 16/22 para Cmin. Considerando valores de CIM de 1 μg/ml, 9/18 niños alcanzaron un valor de ABC24/CIM > 400; si la CIM es de 2 μg/ml 1 solo paciente alcanzó el valor objetivo de ABC24/CIM > 400.
En el tercer día de tratamioento 7/15 niños alcanzaron un valor de Cmax dentro del rango terapeútico y 11/15 para Cmin. Considerando valores de CIM de 1 μg/ml, 7/15 niños alcanzaron un valor de AC24/CIM > 400; si el valor de CIM considerado es de 2 μg/kg solo un paciente alcanzó el valor.
El valor promedio del Vd fue 0,5 lt/kg, t1/2 3,1 hs, y clearance 1,95 ml/kg/min en el primer día. En el tercer día 0,86 lt/kg, 4,5 hs y 2,47 ml/kg/min respectivamente.
En los niños que presenatron balance hídrico (BH)negativo, el valor de Cmax y Cmin fue significativamente mas alto que en aquellos con BH positivo. El valor del Vd fue más elevado en aquellos pacientes que se presentaron con BH positivo 0,6 lt/kg vs 0,3 lt/kg en aquellos con BH negativo. A su vez se determinó la presencia de correlación lineal negativa entre Vd y ABC24/CIM, en el primer día de tratamiento. Y en el tercer día, se encontró correlación lineal negativa entre el clearance y ABC24/CIM. Estos resultados muestran la importancia de tomar en cuenta al BH como un indicador clínico útil que permite estimar el Vd.
Este comportamiento farmacocinético sugiere la utilidad de una dosis carga al inicio del tratamiento como una estrategia terapéutica para alcanzar valores de ABC24/CIM > 400 en las etapas iniciales del tratamiento.En los pacientes con BH positivo se recomienda comenzar el tratamiento con vancomicina con una dosis de carga de 18 a 24mg/kg.
La principal conclusión del presente estudio es haber demostrado que con las dosis actualmente recomendadas de vancomicina menos del 50% de los niños llegaron a AUC24/CIM>400 (CIM=1μg/ml) en el primer día de tratamiento. Se ha plantado el uso de vancomicina en infusión continua con el objetivo de optimizar la terapéutica, pero esta estrategia no ha demostreado beneficio sobre la evolución de las infecciones estafilocócicas.
Como mencionamos anteriormente, valores de AUC24/CIM >400 en las etapas iniciales de tratamiento se asocia con mejores resultados clínicos. Este dato proviene de estudios retrospectivos observacionales y no han sido corroborados en ensayos clínicos controlados y probablemente no lo serán. Sin embargo en función de la información disponible en la actualidad, es recomendable utilizar dosis más elevadas de vancomicina en niños criticamente enfermos con el objetivo de obtener valores de AUC24/CIM > 400.
Se destaca además que los hallazgos del presente estudio reflejan una realidad de los niños criticamente enfermos, que es la variabilidad de los parametros farmacocinéticos. Esto se objetiva principalmente en el valor de la t1/2, que fue menor a la informada en los textos clásicos. Esto refleja una alteración características de los pacientes críricos, que son capaces de excretar en forma más rápida ciertos fármacos, mientras que no exista compromiso de la función renal. Es necesario considerar que los regimenes posológicos no suelen ser determinados en pacientes criticamente enfermos y la variabilidad de los principales determinantes de la farmacocinética (metabolismo hepático, excreción renal, volumen) influye sobre los niveles plasmáticos alcanzados. Además se observó un aumento en los tres parámetros faramcocinéticos claculados entre el día 1 y el día 3. Esto también evidencia otra de las características de los niños criticamente enfermos, la variabilidad de los procesos farnacicinéticos en el curso de la misma enfermedad.
Bibliografia:
- Giachetto G, Telechea H, Speranza N, Oyarzum M, Nanni L, Menchaca A.Vancomycin pharmacokinetic–pharmacodynamic parameters to optimize dosage administration in critically ill children.Pediatr Crit Care Med. 2011 ;12(6):250-4.
- Craig WA: Pharmacokinetic/pharmacodynamic parameters: Rationale for antibacterial dosing of mice and men. Clin Infect Dis 1998; 26:1–12
- Rybak M: The pharmacokinetic and pharmacodynamic properties of vancomycin. Clin Infect Dis 2006; 42(Suppl 1):35–39
- Frymoyer A, Hersh A, Benet L, et al: current recommended dosing of vancomycin for children with invasive methicillin-resistantStaphylococcus aureus infections is inadequate. Pediatr Infect Dis J 2009; 28:398–402
- Moise-Border PA, Forrest A, BirminghamMC, et al: Pharmacodynamics of vancomycin and others antimicrobials in patients with Staphylococcus aureus lower respiratory tract infections. Clin Pharmacokinet 2004; 43:925–942
Colistina y nefrotoxicidad
Pogue JM, Lee J, Marchaim D, Yee V, Zhao JJ, Chopra T, Lephart P, et al. Incidence of and Risk Factors for Colistin-Associated Nephrotoxicity in a Large Academic Health System. Clinical Infectious Diseases 2011; 53: 879-884.
Comenta: Dra. Verónica Seija
La dosificación de colistin utilizada habitualmente en EUA (5 mg/kg/día de colistin base) es mayor que la utilizada en otros países, incluido Uruguay. Recordar la equivalencia 100 mg de colistin base = 3.000.000 en UI = 267 mg de colistin metasulfato. Este es un interesante estudio retrospectivo realizado en el Detroit Medical Center que analiza una cohorte de pacientes que recibieron colistin por más de 48 horas para determinar la incidencia de nefrotoxicidad (de acuerdo a los criterios RIFLE) y sus factores de riesgo.
Se analizaron 126 pacientes, 54 (43%) desarrollaron nefrotoxicidad, 13% en la categoría riesgo, 17% en la de daño y 13% en la de falla de acuerdo a los criterios RIFLE. Los factores de riesgo independientes para la nefrotoxicidad fueron: dosis de colistin ≥ 5.0 mg/kg/día de peso corporal ideal (odds ratio [OR], 23.41; IC 95%: 5.3–103.55), recibir rifampicina en forma concomitante (OR, 3.81; IC 95%:1.42–10.2) y la co administración de ≥3 drogas potencialmente nefrotóxicas (OR, 6.80; IC 95%: 1.42–32.49).
En la discusión del artículo se destaca que los altos niveles de nefrotoxicidad reportados son particularmente alarmantes cuando se analizan junto a los recientes reportes que indican que con dosis bajas de colistin (estándar europeo) no se alcanzarían niveles terapéuticos adecuados. Estos niveles no serían suficientes para tratar infecciones causadas por gérmenes hoy considerados sensibles por los puntos de corte (CIM sensible ≤ 2 μg/ml). En términos de seguridad, un microorganismo con CIM a colistin de 2 μg/ml no podría ser tratado con colistin. Esta CIM es la que habitualmente tienen muchas cepas de P. aeruginosa en nuestro país. Afortunadamente las cepas de A.baumannii habitualemente tiene una CIM ≤ 0,5 μg/ml. Además, el artículo trae nuevas interrogantes en relación a la necesidad de evitar el uso de ciertas drogas, como por ejemplo la rifampicina de manera de disminuir el riesgo de nefrotoxicidad.
Obesidad e influenza
Obesity is associated with impaired immune response to influenza vaccination in humans.
Sheridan PA, Paich HA, Handy J, Karlsson EA, Hudgens MG, Sammon AB, Holland LA,Weir S, Noah TL and Beck MA.
International Journal of Obesity (2011), 1 – 6
Disponible a texto completo en: http://www.nature.com/ijo/journal/vaop/ncurrent/full/ijo2011208a.html
Comenta: Dra. Verónica Seija
Durante la pandemia de Influenza H1N1 de 2009, la obesidad fue reconocida como un factor de riesgo para la morbilidad y mortalidad en las infecciones causadas por este virus.
La vacunación contra la Influenza es unos de los métodos más efectivos para disminuir la morbilidad y mortalidad por esta enfermedad.
En este estudio se comprobó que los pacientes obesos montaron una excelente respuesta inicial contra la vacuna trivalente contra Influenza virus. Sin embargo, a los 12 meses los niveles de anticuerpos en esta población eran mucho más bajos que en la población sin sobrepeso.
La vacunación contra Influenza genera, además de anticuerpos, una repuesta T CD8 +. Estas células T no protegen contra la infección pero si limitan la progresión de la enfermedad, permitiendo un aclaramiento más rápido del virus, disminuyendo así la severidad de la enfermedad. El target de estas células está en las proteínas altamente conservadas (que varían poco año a año) de la parte interna del virus, lo que permite una respuesta cruzada contra diferentes cepas de Influenza virus.
Este estudio encontró que el porcentaje de células T CD8 + estaban disminuidas en la población obesa y que dos marcadores de la funcionalidad de están células (IFNgamma y granzyme B) también estaban disminuidos. Esto sugiere que la protección contra Influenza virus no sería optima en esta población y que la respuesta inmune montada estaría comprometida.